2021
12-27
美国FDA授予Klox伤口护理产品LumiHeal De Novo许可
12月14日,Klox公司独有的伤口护理产品LumiHeal被美国食品和药物管理局(FDA)授予De Novo许可,用于减轻术后伤口的不适症状、促进急性手术伤口愈合、预防术后伤口疤痕生成。
LumiHeal是FDA批准的首款基于FLE线粒体再生技术平台的产品。
作为一种创新性的医疗器械,LumiHeal的机理与FDA批准过的所有器械都不一样,故采取的是De Novo路径准入。
Klox注册事务与合规质保高级总监Daniela Jukic 博士表示:“这是一个严格的程序,在我们与FDA的不懈努力和通力合作下,终于实现了具有里程碑意义的De Novo分类申请的通过。”("It is a rigorous process, and we worked diligently with the FDA to achieve the landmark grant of our De Novo request for classification.")
LumiHeal创造性地利用FLE线粒体再生技术来调节细胞信号通路,使细胞代谢与活动正常化,从而有效防止伤口感染、加快伤口愈合、预防疤痕生成,是一种First-in-class、非侵入性、非热性的独家专利治疗。
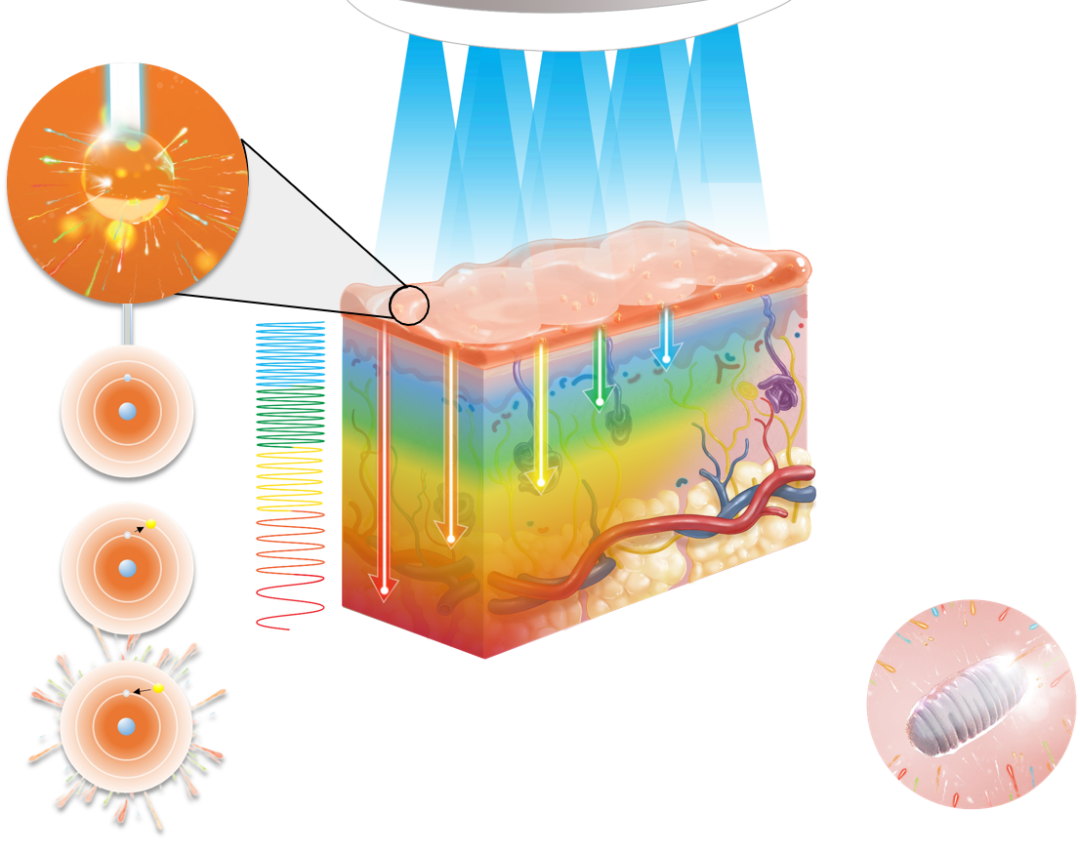
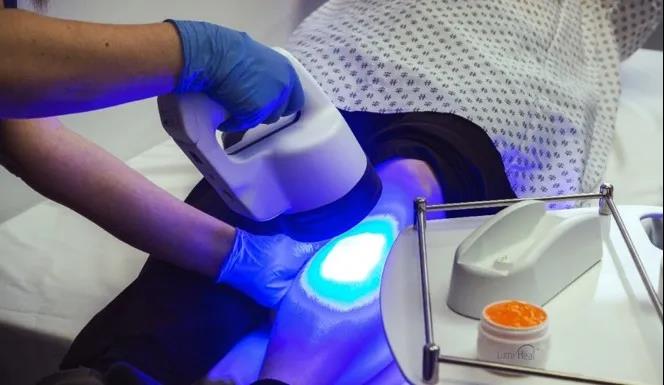
临床试验数据表明,术后伤口患者在使用LumiHeal后手术部位无感染,手术疤痕得到改善;烧烫伤患者在使用LumiHeal后感染的临床症状也有减轻,7-21天内能够完全愈合。
根据FDA定义,被授予First-in-class的药物是指使用全新的、独特的作用机制来治疗某种疾病的药物。也就是说LumiHeal是一款颠覆性的创新治疗,具有里程碑式的巨大突破价值。
LumiHeal Therapeutics,Inc.首席执行官Howard Walthall先生表示,“我们相信,LumiHeal可以为术后伤口的管理提供一个创新有效的治疗方式,并不断为更多患者带去希望”("We believe that the LumiHeal System can make a significant difference in the way we manage post-surgically incisions and opens the way to further indications for the U.S. market")。
LumiHeal在美国获得FDA认证,意味着其在全球范围内又开拓了一个巨大市场,也期待未来不断的创新研发,造福全球更多患者。